NÄSTA ÄMNE
01
Eosinofil esofagit (EoE)
Beskrivning.
Eosinofil esofagit (EoE) är den vanligaste eosinofila gastrointestinala störningen och kännetecknas av i) esofagela symtom såsom intolerans mot matning, gastroesofageal refluxsjukdom (GERD), dysfagi och impaktion (mat fastnar i esofagus), och ii) inflammation med främst eosinofiler, ≥15 eosinofiler per HPF (high power field/högeffektfält) (HPF; standardstorlek på ∼0,3 mm2) i esofageal vävnad efter uteslutande av andra sjukdomar med liknande kliniska, histologiska eller endoskopiska kännetecken.2,3 Det har också beskrivits som en ”livsmedelsantigen-medierad sjukdom”.4 Födoämnesallergi- (FA)-associerad EoE är vanligtvis kopplad till sex olika livsmedel, nämligen komjölk, vete, soja, ägg, nötter och fisk, men kan variera mellan olika regioner och individer.
Prevalens.
Prevalensen av EoE har ökat kraftigt under de senaste två decennierna, delvis på grund av ökad medvetenhet och förbättrad diagnostik.5 Data från USA rapporterade 2018 att den totala prevalensen var 68 per 100 000 (~0,68/1 000) barn <10 år, i ett intervall på 115–123 per 100 000 (~1/1 000) barn och ungdomar (10–19 år).5
I en analys av 14 studier (vuxna och barn) utförda i Nordamerika och Europa, var den totala prevalensen av EoE hos barn 34,4 fall/100 000 (0,34/1 000).6 Enligt andra nyare studier i Spanien var dock prevalensen något högre, 53,4 fall/100 000 (0,54/1000).6 Dessutom verkar EoE genomgående vara högre hos män jämfört med kvinnor, i alla åldersgrupper.5-7
Kostbehandling.
Hos patienter med symtomatisk EoE är protonpumpshämmare (PPI), orala eller topikala glukokortikosteroider och eliminationsdiet effektiva för att inducera histologisk och klinisk remission.7,8 En eliminationsdiet med 6 födoämnen är att föredra framför en eliminationsdiet med 2 eller 4 födoämnen, men är förknippad med lägre följsamhet och ökat antal endoskopier.7 En step-up-strategi har också förespråkats, då man börjar med de vanligaste två livsmedlen, dvs. komjölk och vete/gluten (diet med eliminering av 2 födoämnen (2 FED)); och hos dem där 2 FED inte ger resultat initieras en 4 FED och så vidare till 6 FED.9 I denna studie uppnådde >40 % av barnen remission på 2 FED, 60 % på 4 FED och 79 % på 6 FED.9
Historiskt sett har den här specialkosten ibland använts på grund av dess effektivitet, men idag spelar den en begränsad roll vid behandling av EoE på grund av dålig följsamhet.7 Det rekommenderas därför att dessa dieter ges (endast) till barn med refraktär EoE efter att konventionella behandlingar har misslyckats.7 Tester för matallergi (t.ex. pricktest, specifikt IgE-test och lapptest) rekommenderas inte som metod för att välja vilka livsmedel som ska begränsas.7 När behandlingen väl har påbörjats (kost eller läkemedel) utförs ofta under behandlingen en endoskopi med biopsi eftersom symtomen kanske inte alltid korrelerar med histologisk aktivitet.7 Endoskopiska procedurer som dilatation kan övervägas för vissa (svåra) fall med fibrostenotisk sjukdom.7
02
Food Protein-induced Enterocolitis Syndrome (FPIES)
Beskrivning.
FPIES är en icke-IgE-medierad födoämnesallergi som vanligtvis visar sig i spädbarnsåldern, med upprepade och långvariga kräkningar.10,11 Det har rapporterats att kräkningarna vid fall av akut FPIES börjar cirka 1 till 4 timmar efter födointag, ofta åtföljda av slöhet och blekhet.10,11 Dessutom har vattnig diarré (ibland med blod och slem) rapporterats inom 5 till 10 timmar efter intaget av födan och diarrén kan vara i upp till 24 timmar.10,11 En potentiell biverkning av akut FPIES är uttorkning, vilket i allvarliga fall kan leda till hypotoni och chock.10,11 Symtomen på akut FPIES försvinner dock vanligtvis inom 24 timmar och de flesta barn med akut FPIES mår bra mellan episoderna och uppvisar normal tillväxt.10,11
Kronisk FPIES ses oftast hos spädbarn som är yngre än 4 månader och som får modersmjölksersättning innehållande komjölk eller soja, där den allergena maten intas regelbundet och upprepade gånger.10,11 Symtomen yttrar sig som kronisk/intermittent kräkning, vattnig diarré, hypoalbuminemi och hämmad tillväxt.10,11. När den föda som utlöst reaktionen elimineras försvinner symtomen, men ett senare intag av födoämnet (oavsiktlig exponering eller oral födoämnesprovokation) kan inducera en akut FPIES-episod inom 1 till 4 timmar efter intaget.10,11
Komjölk verkar vara den flytande föda som oftast är orsaken till FPIES – i en studie av oral födoämnesprovokation (Oral Food Challenge, OFC) reagerade 58 % på komjölk.12 En kombination av soja och komjölk verkar vara allmänt kopplad till FPIES i USA (25 % till 50 % rapporterade), liksom ris och havre.10 Den vanligaste rapporterade vardagsmaten är mjölk och soja vad gäller flytande föda och spannmål (ris, havre) vad gäller fast föda.11 Hos majoriteten av barnen (65 %) verkar dock FPIES orsakas av ett enda födoämne.13
Prevalens.
Den kumulativa incidensen i USA, Israel, Australien och Spanien beräknas vara mellan 15 och 700 fall/100 000 (0,15–7/1 000).14 I en populationsbaserad undersökning i USA rapporterades en beräknad livstidsprevalens på 510 fall/100 000 (~5/1 000) hos personer yngre än 18 år och 220 fall/100 000 (~2/1 000) hos vuxna.15 Vad gäller barn i västvärlden rapporterades prevalensen av FPIES mot komjölk till 340 fall/100 000 (~3/1 000).16
Kostbehandling.
Behandlingen av akut FPIES beror på hur allvarlig allergin är hos det enskilda barnet. Lindrigare reaktioner kan gå tillbaka med oral rehydrering, medan måttliga till svåra reaktioner kräver mer aggressiva åtgärder, inklusive återvätskning (med upprepade bolusdoser).11 Långsiktig behandling av FPIES inkluderar undvikande av de utlösande livsmedlen, uppföljning av kost och nutrition, behandling av reaktioner vid oavsiktligt intag eller nya utlösande livsmedel, samt återkommande utvärderingar avseende eventuell resolution.11 För spädbarn med komjölk- eller sojarelaterad FPIES rekommenderas amning eller användning av extensivt hydrolyserad specialnäring (eHF).11 Internationella FPIES-riktlinjer rekommenderar inte att ammande mödrar rutinmässigt undviker allergener om inte barnet uppvisar symtom under amning (vilket är sällsynt).16 De flesta spädbarn tolererar eHF, men 10–20 % kan behöva en aminosyrabaserad specialnäring (AAF).10,11 Vid FPIES varierar den totala remissionsfrekvensen kraftigt från 50 till 90 % vid 6 års ålder, och tidpunkten för remission verkar vara beroende av både den allergiframkallande födan och den studerade populationen.13 Tolerans mot komjölk och soja uppnås vanligtvis tidigare än mot spannmål eller annan fast kost.11
03
Food Protein-Induced Enteropathy (FPE)
Beskrivning.
FPE är ett ovanligt syndrom med tunntarmsskador som leder till malabsorption.13 Symtomen inkluderar icke-blodiga diarréer, malabsorption, enteropati med åtföljande proteinförlust samt hypoalbuminemi och hämmad tillväxt.13 Det kännetecknas också av onormal tunntarmsslemhinna och kroniska gastrointestinala symtom så länge livsmedlet intas regelbundet.13 FPE börjar vanligtvis under de första levnadsmånaderna, oftast inom några veckor efter introduktion av modersmjölksersättning innehållande komjölk och visar sig som återkommande kräkningar, (icke-blodig) diarré, malabsorption, hämmad tillväxt, utspänd buk och hypoalbuminemi.17–19 Komjölk och soja är vanliga allergena livsmedel men även andra livsmedelsproteiner, såsom vete och ägg, har rapporterats.13,18,19 FPE kan vara svårt att skilja från vissa former av FPIES; även om den saknar både de akuta symtomen som ses vid FPIES och den allvarliga uttorkning och metaboliska acidos som kan ses vid kronisk FPIE.18
Prevalens.
I en populationsbaserad finsk studie var prevalensen av FPE orsakad av komjölk 2 200 fall/100 000 (~22/1 000) hos äldre barn.20 Även om den totala prevalensen av FPE är okänd tyder rapporter på att prevalensen av denna icke-IgE-medierade överkänslighet har minskat under de senaste decennierna.13,18,19 Möjliga förklaringar till den minskade prevalensen av FPE är ökad amning, som kan vara skyddande, och ökad användning av bättre anpassade specialnäringar med lägre proteininnehåll.18,19
Kostbehandling.
Hörnstenen i hanteringen av FPE är att undvika de livsmedel som orsakar besvären. Hos barn med FPE försvinner symtomen vanligtvis inom 1–4 veckor efter eliminering av det utlösande livsmedlet, även om det kan ta upp till 18 månader för slemhinnorna att läka och disackaridasaktiviteten att normaliseras.13 Till spädbarn som matas med modersmjölksersättning rekommenderar riktlinjerna eHF som förstahandsalternativ, särskilt till spädbarn yngre än 6 månader med tecken på hämmad tillväxt. Om eHF inte tolereras eller om barnets första utlösande faktor är en eHF rekommenderas en aminosyrabaserad specialnäring (AAF).13 Om undvikande av komjölk inte förbättrar symtomen kan man prova med eliminering av andra livsmedel (t.ex. soja, ägg, vete), ett i taget.18
04
Food Protein-Induced Allergic Proctocolitis (FPIAP)
Beskrivning.
FPIAP anses vara den mest godartade formen av icke-IgE-medierad födoämnesallergi, som kännetecknas av blod och ibland slem i avföringen hos i övrigt friska, normalt växande spädbarn.18 Det drabbar spädbarn <12 månaders ålder och uppträder vanligtvis mellan 2 och 8 veckors ålder. Reaktionen kan vara akut (<12 timmar efter exponering) men är vanligtvis allvarligare, med en gradvis ökning av symtomen i takt med att livsmedelsproteinet introduceras.18 Symtom vid FPIAP är en lokal inflammation i distala tjocktarmen som leder till hematochezi (blod i avföringen) hos i övrigt synbarligen friska spädbarn19 (bild 1). En prevalens på upp till 60 % av alla barn som ammas har föreslagits.21 Komjölk är den vanligaste utlösande faktorn vid FPIAP (i likhet med FPIES och FPE), men även soja kan vara inblandat.19,21
Prevalens.
Av de icke-IgE-medierade gastrointestinala födoämnesallergierna är FPIAP den vanligaste, även om den exakta prevalensen inte är helt fastställd.19 En stor studie av en israelisk födelsekohort visade att den totala prevalensen av FPIAP var relativt låg, 160 fall/100 000 (1,6/1 000).22 Hos spädbarn med rektal blödning har FPIAP visat sig vara orsaken i 18–64 % av fallen.23,24
Kostbehandling.
De allra flesta helammade barn med FPIAP svarar bra när alla mjölkprodukter elimineras från moderns kost. Ibland kan det dock vara nödvändigt att utesluta flera födoämnen, vanligtvis soja, ägg och/eller vete.16,19,21 Nya europeiska riktlinjer rekommenderar en 2–4 veckors eliminationsdiet för modern, följt av ett försök att återinföra livsmedel för att bekräfta diagnosen.16 Om eliminationsdieten för modern misslyckas eller om barnet inte helammas kan ett extensivt hydrolysat provas. Om, trots eliminationsdiet, hematochezi kvarstår är en aminosyrabaserad specialnäring indicerad.19,21 Sojaersättning kan framkalla blödning hos en undergrupp av spädbarn som reagerar på komjölk, så soja elimineras också ofta samtidigt som komjölken, åtminstone under den diagnostiska perioden av eliminationsdieten.21
Bild 1. Gastrointestinala organ som påverkas vid de olika icke-IgE-medierade gastrointestinala födoämnesallergierna.
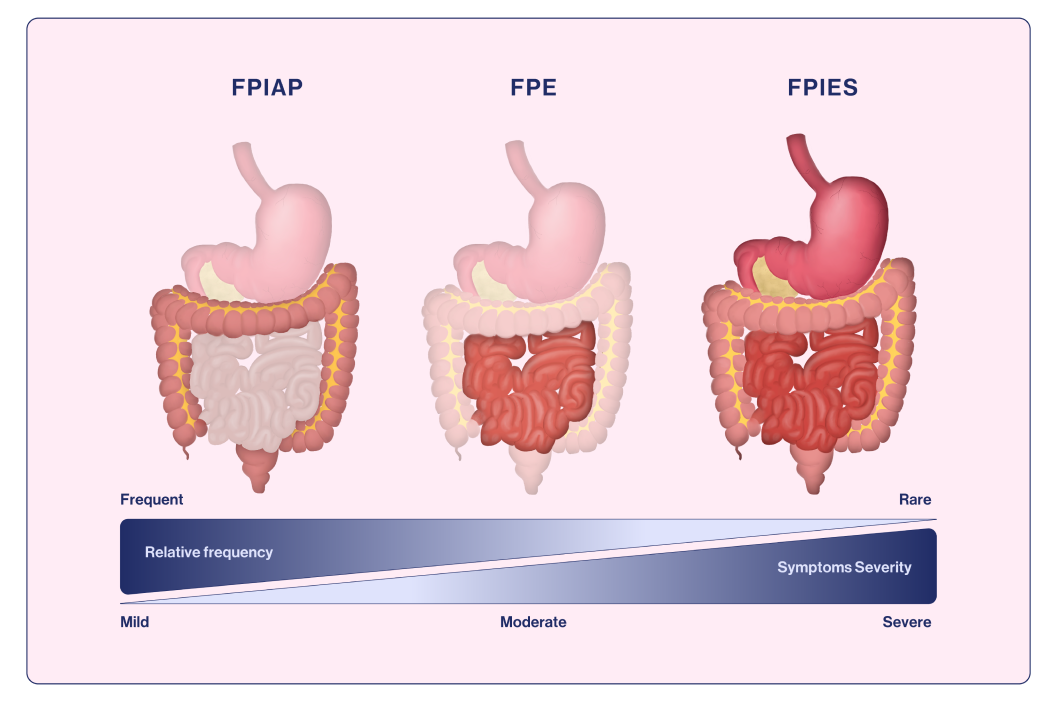
Anpassad från Labrosse et al., 202019
05
Allergisk dysmotilitet
Beskrivning.
Gastroesofageal reflux (GER) definieras som passage av maginnehåll till matstrupen vilket kan leda till uppstötningar och intermittenta kräkningar.25 När GER leder till besvärliga symtom kallas det GER-sjukdom (GERD).25 Typiska symtom på GERD är återkommande uppstötningar och kräkningar hos spädbarn, med eller utan överdriven gråt, oro/obehag/irritabilitet, dystonisk hållning av nacken, matningssvårigheter och matvägran, hämmad tillväxt och esofagit. Hos äldre barn kan symtomen även innefatta smärta i bröst och epigastrium samt dysfagi.25
Mekanismerna bakom GERD är flera, men den dominerande mekanismen tillskrivs tillfällig avslappning av nedre esofagussfinktern (LOS). Både IgE-medierad, icke-IgE-medierad och blandad IgE-/icke-IgE-medierad födoämnesallergi (FA) (inklusive KMPA) har föreslagits ligga bakom GERD.25 FA-associerad GERD, främst icke-IgE-medierad, har beskrivits hos småbarn, där majoriteten fick sina första symtom inom de första 6 levnadsmånaderna, med matvägran och hämmad tillväxt.25
Förhållandet mellan födoämnesallergi och GERD är sannolikt dubbelriktat. GERD inducerar förändringar i slemhinnans immunitet som i sin tur kan öka risken för FA, och FA-relaterade symtom orsakade av matsmältningsdysmotilitet kan bero på matallergen-inducerade mediatorer.25
Prevalens.
Ett antal studier har undersökt förekomsten av komjölksproteinallergi (KMPA) hos spädbarn med symtom på GERD. I vissa mindre, äldre studier rapporterades KMPA-associerad GERD variera mellan 16 och 56 %.26–29 En senare granskning drog dock slutsatsen att den verkliga prevalensen mellan KMPA och GERD fortfarande är oklar.30
Kostbehandling.
Det vanligaste allergenet som rapporteras vid FA-associerad GERD är komjölk enligt EAACI:s senaste position paper.25 Det första steget i den diagnostiska processen är att ta upp en detaljerad klinisk anamnes, bedöma tillväxt och matningshistorik (inklusive eventuella kostförändringar i samband med försämring av symtomen) samt avgöra om det finns andra atopiska symtom25 (bild 2). En familjeanamnes med atopi och tidigt debuterande eksem bör också fastställas eftersom det kan öka risken för att barnet får en allergisk sjukdom.25 När KMPA-associerad GERD har fastställts föreslår experterna att man för (icke-ammade) spädbarn överväger en diet där komjölk eliminerats innan läkemedel sätts in.31 I EAACI:s position paper föreslogs minst 2 veckor på eliminationsdiet innan symtomen börjar förbättras.25 Det kan dock ta upp till 6 veckor i vissa fall, vilket sedan bör följas av återintroduktion av allergenet (givet dagligen i åldersanpassade portioner i cirka 2 veckor).25 Eliminering av komjölk/mejeriprodukter från spädbarnsdieten har visat sig avsevärt minska reflux och clearance av magsyra, vilket tyder på förbättrad peristaltik i matstrupen.32
Amning ska rekommenderas för spädbarn med GERD och en eliminationsdiet för modern ska endast övervägas om barnet uppvisar symtom under amning.25 När bröstmjölk inte finns tillgänglig, eller barnet inte helammas, rekommenderas en extensivt hydrolyserad specialnäring (eHF) som förstahandsval. EAACI har dock föreslagit att när barnet har hämmad tillväxt, involvering av flera organ, eller när flera födoämnen misstänks ligga bakom besvären, kan en aminosyrabaserad specialnäring (AAF) övervägas.25 EAACI menade också att en mer trögflytande eHF eller aminosyrabaserad specialnäring kan ge vissa ytterligare fördelar hos spädbarn med pågående gastrointestinala symtom.25
I EAACI:s dokument föreslås även att om symtomen inte förbättras fullt ut (t.ex. på diet utan komjölk) och det finns andra pågående lägre gastrointestinala symtom som kan vara relaterade till icke-IgE-medierad FA och/eller atopisk dermatit, kan ytterligare eliminering av födoämnen behöva övervägas (dvs. soja, ägg och vete).25
Efter 6–12 månaders eliminering av födoämnen (när matallergirelaterad GERD bekräftats) bör återintroduktion av allergenerna initieras, enligt EAACI-experterna.25
EAACI föreslog att protonpumpshämmare (PPI) kan användas till småbarn och barn i skolåldern med FA-associerad GERD, medan farmakologiska behandlingar av spädbarn (1 år) endast bör övervägas efter att en eliminationsdiet inte gett resultat.25
Bild 2. Föreslagen rutin för diagnostik och behandling av FA-associerad GERD enligt EAACI:s position paper.
Anpassad från Meyer et al., 202225
References:
1). Heine RG. Chem Immunol Allergy. 2015;101:171-80.
2). Dellon ES, et al. Gastroenterology 2018; 155:1022-33.
3). Vandenplas Y, et al. JPGN. ESPGHAN. 2023.
4). Kliewer KL, et al. J Allergy Clin Immunol. 2016 Apr;137(4):1011-1014.
5). Kamat, Siddhesh, et al. The American Journal of Gastroenterology.2021; 116():p S184-S185,
6). Navarro P, et al., Alimentary Pharmacology & Therapeutics. 2019: 49: 1116 - 1125.
7). Dhar A, et al. Gut 2022;71:1459-1487.
8). Hirano I, et al. Gastroenterology. 2020 Vol 158: 6. 1776 - 1786.
9). Molina-Infante J, et al. J Allergy Clin Immunol. 2018 Apr;141(4):1365-1372. (NOTE only 2018 not 2016)
10). Nowak-Węgrzyn A, et al. Journal Allergy & Clinical Immunology. 2017; Vol 139 No 4: 1111 – 1126.
11). Leonard SA, et al. World Allergy Organ J 2018 11, 4.
12). Caubet JC, et al. J Allergy Clin Immunol. 2014 Aug;134(2):382-9.
13). Connors L, et al. Allergy Asthma Clin Immunol. 2018 Sep 12;14(Suppl 2):56.
14). Mathew M, et al. Allergy Asthma Immunol Res. 2022 Nov;14(6):587-603.
15). Nowak-Węgrzyn A, et al. J Allergy Clin Immunol. 2019; Oct;144(4):1128-1130.
16). Meyer R, et al. Allergy. 2020; 75: 14– 32.
17). Nowak-Węgrzyn A, et al. J Allergy Clin Immunol. 2015;135(5):1114–24.
18). Tam J. J Food Allergy. 2020: 2:55–58.
19). Labrosse R, et al. Nutrients. 2020; 12(7):2086.[add number to visual]
20). Kokkonen J, et al. Acta Paediatr. 2004 Jul;93(7):880-6.
21). Dupont C. Ann Nutr Metab. 2018;73(suppl 4):8–16.
22). Elizur A, et al. Pediatr Allergy Immunol. 2012 Dec;23(8):766-70.
23). Arvola T, et al. Pediatrics. 2006 Apr;117(4):e760-8.
24). Xanthakos S, et al. Journal of Pediatric Gastroenterology and Nutrition. 2005;41(1):p 16-22.
[17:00] Jo Grvey (Guest)
25). Meyer R, et al. Pediatr Allergy Immunol. 2022;33:e13856. [add number to visual]
26). Milocco C, et al. Arch. Dis. Child. 1997, 77, 183.
27). Staiano A, et al. Arch. Dis. Child. 1995, 73, 439–442
28). Cavataio F, et al. J Pediatr Gastroenterol Nutr. 2000;30 Suppl:S36-44.
29). Nielsen RG, et al. J. Pediatr. Gastroenterol. Nutr. 2004, 39, 383–391.
30). Salvatore S, et al. Nutrients. 2021; Jan 21;13(2):297.
31). Rosen R, et al. J Pediatr Gastroenterol Nutr. 2018;66:516-554.
32). Omari T, et al. Journal of Pediatric Gastroenterology and Nutrition 2020: 70(4):p 489-496.


